Date:
After intensive trials, all parties have finally selected three drugs with clinical progress of small molecular compounds that can be used in the treatment of COVID-19 patients. Among them, Favelavir tablets (also known as Favelavir tablets), developed by Toyama Chemical Co., LTD., a subsidiary of Japan's Fujifilm Group, and released in Japan from March 2014, are among them.

(注:科技日报报道入组26例,但很多报道却是70例)
巧合的是:海正药业现已基本完成仿制药开发。秉承特事特办原则,CDE夜以继日工作,以最快速度批准了该药上市。令人欣喜的是,《审批结论》中有如下要求:
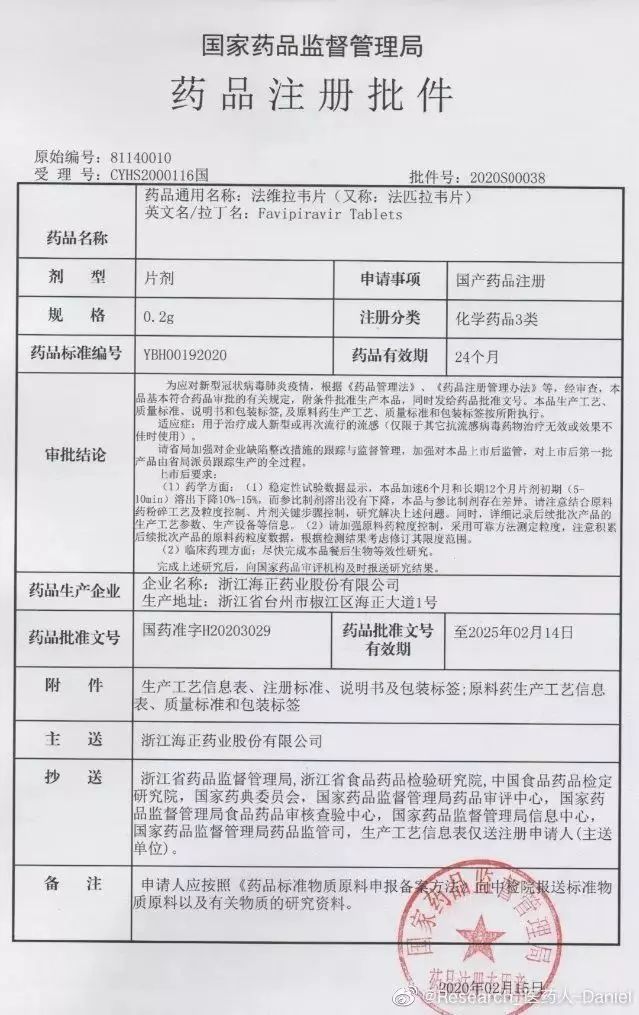
1)本品加速6月和长期12月溶出曲线明显下降,而原研制剂未变化,两者存在差异,请在后续大生产予以关注并解决。
2)加强粒度控制。
3)尽快补充餐后BE试验。
4)杂质 只字未提,但在备注栏写到“请将研究资料提交至中检院”。
此次审评结论如此关注溶出、无视杂质,实属罕见。
首先,审评负责人意识到货架期产品溶出曲线的重要性,故以“稳定性样品溶出曲线也需与原研药一致”来进一步完善仿制制剂质量(0天样品肯定与原研一致),以保证效期内产品的生物利用度与原研一致;
其次,由于本品API为难溶、粒度与溶出曲线密切相关,故要求加强和严格日常质控,确保未来每批产品溶出曲线与原研的一致性与稳定性;针对杂质,却认为关键时期不必再抠,只要检验合格即可。
更大开大合的是:海正药业尚未开展餐后BE试验,仅完成空腹也被批准了,想必是审评老师知晓“日本不做餐后、只做空腹”的规定,艺高人胆大地活学活用一把。在此,为该审评负责人点赞。希望未来“关注溶出、少抠杂质”的审评意见越来越多,把有限资源引导到药物有效性上,尽快改变我国对杂质穷追不舍、自我陶醉之现状。
最后,寄望海正产品能在即将到来的真刀真枪中不辱使命,具有与原研药一致的临床疗效,打赢国产仿制药翻身仗,通过严格的溶出质控为国产仿制药正名。
【声明】
以上仅代表个人观点,不代表所在单位,还请异议者海涵。